第五节 胆固醇调节组件结合蛋白
一、胆固醇调节组件1的功能和定位
编码低密度脂蛋白受体(LDL-R)的基因5'侧翼区,具有一个长10个碱基对的胆固醇调节组件1(sterol regulatory element 1,SRE-1)。SRE-1是一个条件正性调节组件,仅在细胞内胆固醇缺乏的条件下,才被激活。在其他的胆固醇调节基因如羟甲基戊二酸单酰CoA合酶(HMGCoa synthase )基因的启动子中也含有SRE-1,而在羟甲基戊二酸单酰CoA还原酶(HMGCoa reductase )基因的启动子中含有类似于SRE-1的胆固醇调节组件(SRE)。SRE-1通过调节LDL-R基因、HMGCoA合酶基因的翻译,控制细胞对外源性胆固醇的摄取量和内源性胆固醇的合成速率,调节细胞内胆固醇含量。SRE-1在LDL-R基因5'侧翼区的定位见图7-9。

图7-9 +1表示翻译起始位点,T/A表示TATA盒,空心箭头表示重复区,重复区1、重复区3可能和Sp1(一种正性翻译因子)结合。重复区2内含有SRE-1。
二、SREBPs的发现和命名
1989年,Tripathi B.Rajavashisth发现了一种能和SRE结合的锌脂蛋白。1993年,MichaelR.Briggs等人,利用离子交换层析、凝胶过滤和DNA亲和层析的方法,从人类宫颈癌细胞(Hela细胞)核的提取物中分离出了这一组能与SRE-1结合的蛋白质,并将其命名为胆固醇调节组件结合蛋白(sterol regulatory element-binding proteins, SREBPs)。SREBPs在细胞胆固醇缺乏的情况下,通过和SRE-1的结合,激活LDLR基因、HMGCoA合酶基因的翻译。
三、SREBPs的结构和分类
SREBPs具有“碱性螺旋-环-螺旋-亮氨酸拉链”(basic helix-loop-helix-leucine zipper, bHLH-ZIP)结构,是bHLH-ZIP蛋白系列的一种。bHLH-ZIP蛋白包含一系列能特异性地和含E盒(e box, CANNTG)的DNA结合的蛋白质,例如:调节免疫球蛋白基因翻译的TFE3,致肿瘤蛋白Myc等。SREBPs虽是bHLH-ZIP蛋白中的一种,但又不同于其他的bHLH-ZIP蛋白。一方面,SREBPs分子量大,含1140个左右的氨基酸残基;另一方面,SREBPs不识别E盒(e box)而特定地识别SRE-1中直接重复的“CAC”序列。
迄今为止,发现有两种SREBPs。一种称SREBP-1,另一种称SREBP-2。SREBP-1又由于其mRNA剪接方式的不同,以三种功能上完全相同,组成上略有不同的形式大量存在,这三种形式的蛋白分别称为SREBP-1a、SREBP-1b、SREBP-1c。其中,SREBP-1a是SREBP-1的主要存在形式,故本文以SREBP-1a为例来描述SREBP-1。SREBP-1a含1147个氨基酸残基。分子量为125kD。至今,还没有发现SREBP-2存在多种不同的剪接后蛋白。SREBP-2含1141个氨基酸残基,分子量为121kD,与SREBP-1a之间有47%的同源性,含高度保守的bHLH-ZIP区,和SREBP-1a的bHLH-ZIP区有71%的一致性。但是SREBP-2含有不同SREBP-1a的谷氨酸富集区(在121个氨基酸残基中含多于27%的谷氨酸残基。SREBP-1a和SREBP-2的氨基酸序列和功能域结构之间的比较参见图7-10(A、B、C)。

图7-10 A:SREBP-2和SREBP-1a氨基酸序列之间的比较
“--”表示二者的相同部分
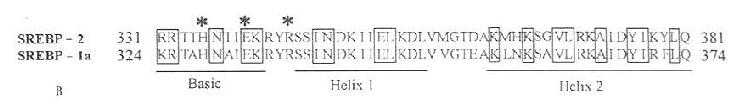
图7-10 B:SREBP-2和SREBP-1a的bHLH区(粗横线所示)的比较

四、SREBPs的生理功能
两种SREBPs利用位于其氨基酸残基470~570之间的疏水序列,附着于内质网膜和核膜,在氨基端的470个氨基酸残基组成的肽链中,均含“碱性螺旋-环-螺旋-亮氨酸拉链”的核心结构,使蛋白质能形成均一二聚体,并能和SRE-1结合。两种蛋白质氨基端一侧的结构中,都有酸性区域,可能作为DNA翻译的增强子。当人或仓鼠细胞在缺乏胆固醇的环境中培养时,蛋白酶在亮氨酸拉链和膜间的附着区处裂解SREBPs,并从膜上释放出水溶性的氨基端的裂解片段,这一片段约含470个氨基酸残基,表现分子量为68kD。这一片段能够移行入胞核,结合于SRE-1,从而激活LDLR基因翻译和HMGCoA合酶基因翻译。
SREBPs裂解、移行入胞核,进而结合于SRE-1,以致激活LDLR基因、HMGCoA合酶基因,都有赖于细胞内缺乏胆固醇。因为胆固醇能够抑制SREBPs的裂解。而已形成的SREBPs的裂解片段又很容易被迅速分解,从细胞核中快速消失。故而胆固醇的存在,将阻断整个调节通路,使SRE-1失活。
将SREBP-1和SREBP-2进行cDNAg隆,并采用质粒转染动物细胞的方法,使培养细胞,如Hela细胞和中国仓鼠卵巢细胞(CHO细胞),表达SREBP-1和SREBP-2,发现他们调节细胞内胆固醇代谢的过程是一致的,功能上是协同的,然而两种蛋白质是单独发生作用,没有发现杂化二聚体。为什么存在这两种组成不同但功能一致的SREBPs,原因还不清楚。
研究仓鼠肝脏中产生的,由细胞内胆固醇含量调节的mRNA(包括LDLR和HMGCoA合酶的mRNA)的含量。肝脏经HMGCoA还原酶抑制物mevinolin处理后,这两种mRNA的量都增加。通过阻止胆固醇的合成,mevinolin诱导暂时的胆固醇水平降低,而增强胆固醇调节基因的翻译。当mevinolin和胆汁酸结合树酯,如降胆灵合用时,mevinolin增强翻译的效果更强。降胆宁通过阻止肠道对胆汁酸的再吸收,使胆固醇转变为胆汁酸,因而增加肝脏对胆固醇的进一步需求。
最近,研究HMGCoA还原酶抑制物和胆汁酸结合树酯是否促进SREBP-1和SREBP-2在仓鼠肝脏中的蛋白裂解,与在培养的细胞中的发现有些不同。资料表明SREBP-1和SREBP-2的裂解片段在仓鼠肝脏中的调节作用是不一致的。仓鼠肝脏经mevinolin 加降胆宁处理后,SREBP-2的裂解片段增多,而SREBP-1的裂解片段减少。这一结果似乎表明在仓鼠肝脏中,SREBP-1对LDLR和HMGCoA合酶基因的基础翻译起作用,而SREBP-2对经胆汁酸结合树酯和胆固醇还原酶抑制物处理后,形成的胆固醇缺乏状态的基因翻译起作用。
另有报道,胰岛素和类胰岛素生长因子Ⅰ也可以通过SREBP-1介导LDL-R启动子的激活,从而调节细胞内的胆固醇含量。
总之,在细胞内胆固醇含量的自我平衡中,SREBPs起了重要作用,其详细机制的阐明,必然对胆固醇代谢调节的研究产生重大影响。
(董学梅 滕思勇 郑芳 崔天盆)
