参考资料
别构机制的模式
为了解释别构酶协同效应的机制并推导出动力学曲线的方程式,不少人曾提出过各种模式,各有优缺点,现在主要把Hill模式叙述如下:
Hill模式
在协同结合模式中最早的一种是Hill在1909年提出的,企图解释氧结合至血红蛋白的S形饱和曲线,现称为Hill模式,后来经Atkinson应用于别构酶反应,他设想在这个系统中,n分子的配体(S)能够一步结合到酶上去:
即此反应的总解离常数(K's)由下式决定
K'S=[E][S]n/[ESS]
(6-7)
而酶的饱和分数
YS=每分子酶蛋白上已结合的底物分子数/每分子酶蛋白上底物结合位点的总数
(6-8)
又因总的酶浓度[E0]=[E]+[ES0]
故 YS=[ESn]/[E0]=[ESn]/[ESn]+[E]
(6-9)
合并式6-7和式6-9,消去[ESn],则
YS=[S]n/K'S+[S]n
(6-10)
YSK'S+YS[S]n=[S]n,
YSK'S=(1-Y)[S]n
(6-11)
Ys/1-Ys=[S]n/K'S
(6-11)
log
YS
=nlog[S]-logK'S
(6-13)
1-YS
因此以 对log[S]作图的话,可得斜率为n,纵轴截距为-logK'S的直线(见下图)。
对log[S]作图的话,可得斜率为n,纵轴截距为-logK'S的直线(见下图)。
因v=k0[ESu],Vm=k0[E0],故 =[ESu]/[E0]=v/vω
=[ESu]/[E0]=v/vω
(6-14)
将式6-10代入式6-14,即得
[S]n/K'S+[S]n=v/Vm
Vm[S]n=K'Sv+v[S]n
(6-15)
(Vm-v)[S]n=K'Sv
(6-16)
v/Vm-v=[S]n/K'S
(6-17)
logv/Vm-v=nlog[S]-logK'S
(6-18)
式6-13或6-18即为Hill方程式,式6-18如以logv/Vm-v对log[S]作图,也可得一直线(见下图)。
Hill作图法
如v=Vm/2时,式6-19为log1=nlog[S]-logK'S=0(6-19)
此时的[S]即S0.5,故nlogS0.5=logK'5(6-20)式6-18所得的直线斜率为n,纵轴截距为-logk'S,而横轴截距为logK'S/n,即log[S]0.5,但[S0.5]也可在已知logK'S后通过式6?0求取。
上节已述及,S0-5就相当于米曼氏动力学中的Km,当K0《k-1/k1时,可反映别构酶对底物的亲和力,S0.5愈小,亲和力愈大,而K's实际上已与亲和力关系不大,因受到n的影响。故反映底物亲和力的参数,已从非别构酶的Km一项移到别构酶的[S]一项,并且式6?0可看出K'S是随[S]而改变的,不是一个常数。由于K'S的测定是假设V=(1/2)Vm或[S]=S0.5的条件下计算的,故有些作者用S0.5S,来代表别构酶的K'5,以免与Km混淆。
Hill作图法的斜率n,称为Hill系数,即前述的协同系数,一般可用nH或h代表。当nH=1时,式6-1变为V=Vm[S]/(K1+[S]),即米曼氏方程式,表示无协同作用,此时K'或S0.5S,=S0-5=Km,至于nH>1为正协同,nH<1为负协同。
Hill模式比较简单,式6-1或式6-10都是S形曲线方程式,但有不少缺点:(1)按理,Hill系数应等于酶分子中可能有结合底物的位点数,但因忽略了ESn-1,ESn-2…ES1等中间形式的酶底物复合体,根据Hill氏作图计算出来的n值一般均低于真实的位点数。以别构蛋白Hb为例,理论上每分子Hb可结合四分子氧,即n=4,但计算结果n=2.6~2.8。在负协同效应时,每分子酶也结合n个底物(n>1)但计算结果却是n<1。故Hill系数已不能代表结合底物的位点数,而只能作为底物协同性的指标。(2)在S浓度过高(酶90%以上被S饱和)或过低(酶仅10%以下被S饱和)时,Hill线的斜率n常等于1,故当测定别构酶活力时,[S]的范围较广,得出的Hill线不是直线而是折线(见下图)。(3)n分子的底物同时和酶作用,反应的级数为n+1,如n-4则为五级反应,这在动力学上是不可能的。但尽管如此,Hill作图法仍不失是一个求取别构酶S0.5和鉴定协同类型及协同作用大小的常用方法。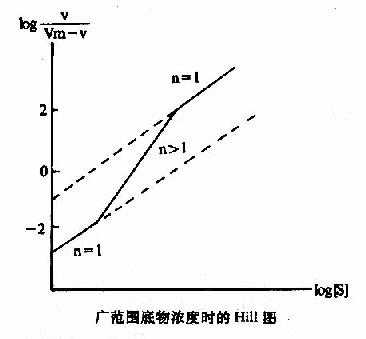
广范围底物浓度时的Hill图
为了解释别构酶协同效应的机制并推导出动力学曲线的方程式,不少人曾提出过各种模式,各有优缺点,现在主要把Hill模式叙述如下:
Hill模式
在协同结合模式中最早的一种是Hill在1909年提出的,企图解释氧结合至血红蛋白的S形饱和曲线,现称为Hill模式,后来经Atkinson应用于别构酶反应,他设想在这个系统中,n分子的配体(S)能够一步结合到酶上去:

即此反应的总解离常数(K's)由下式决定
K'S=[E][S]n/[ESS]
(6-7)
而酶的饱和分数
YS=每分子酶蛋白上已结合的底物分子数/每分子酶蛋白上底物结合位点的总数
(6-8)
又因总的酶浓度[E0]=[E]+[ES0]
故 YS=[ESn]/[E0]=[ESn]/[ESn]+[E]
(6-9)
合并式6-7和式6-9,消去[ESn],则
YS=[S]n/K'S+[S]n
(6-10)
YSK'S+YS[S]n=[S]n,
YSK'S=(1-Y)[S]n
(6-11)
Ys/1-Ys=[S]n/K'S
(6-11)
log
YS
=nlog[S]-logK'S
(6-13)
1-YS
因此以
 对log[S]作图的话,可得斜率为n,纵轴截距为-logK'S的直线(见下图)。
对log[S]作图的话,可得斜率为n,纵轴截距为-logK'S的直线(见下图)。因v=k0[ESu],Vm=k0[E0],故
 =[ESu]/[E0]=v/vω
=[ESu]/[E0]=v/vω(6-14)
将式6-10代入式6-14,即得
[S]n/K'S+[S]n=v/Vm
Vm[S]n=K'Sv+v[S]n
(6-15)
(Vm-v)[S]n=K'Sv
(6-16)
v/Vm-v=[S]n/K'S
(6-17)
logv/Vm-v=nlog[S]-logK'S
(6-18)
式6-13或6-18即为Hill方程式,式6-18如以logv/Vm-v对log[S]作图,也可得一直线(见下图)。

Hill作图法
如v=Vm/2时,式6-19为log1=nlog[S]-logK'S=0(6-19)
此时的[S]即S0.5,故nlogS0.5=logK'5(6-20)式6-18所得的直线斜率为n,纵轴截距为-logk'S,而横轴截距为logK'S/n,即log[S]0.5,但[S0.5]也可在已知logK'S后通过式6?0求取。
上节已述及,S0-5就相当于米曼氏动力学中的Km,当K0《k-1/k1时,可反映别构酶对底物的亲和力,S0.5愈小,亲和力愈大,而K's实际上已与亲和力关系不大,因受到n的影响。故反映底物亲和力的参数,已从非别构酶的Km一项移到别构酶的[S]一项,并且式6?0可看出K'S是随[S]而改变的,不是一个常数。由于K'S的测定是假设V=(1/2)Vm或[S]=S0.5的条件下计算的,故有些作者用S0.5S,来代表别构酶的K'5,以免与Km混淆。
Hill作图法的斜率n,称为Hill系数,即前述的协同系数,一般可用nH或h代表。当nH=1时,式6-1变为V=Vm[S]/(K1+[S]),即米曼氏方程式,表示无协同作用,此时K'或S0.5S,=S0-5=Km,至于nH>1为正协同,nH<1为负协同。
Hill模式比较简单,式6-1或式6-10都是S形曲线方程式,但有不少缺点:(1)按理,Hill系数应等于酶分子中可能有结合底物的位点数,但因忽略了ESn-1,ESn-2…ES1等中间形式的酶底物复合体,根据Hill氏作图计算出来的n值一般均低于真实的位点数。以别构蛋白Hb为例,理论上每分子Hb可结合四分子氧,即n=4,但计算结果n=2.6~2.8。在负协同效应时,每分子酶也结合n个底物(n>1)但计算结果却是n<1。故Hill系数已不能代表结合底物的位点数,而只能作为底物协同性的指标。(2)在S浓度过高(酶90%以上被S饱和)或过低(酶仅10%以下被S饱和)时,Hill线的斜率n常等于1,故当测定别构酶活力时,[S]的范围较广,得出的Hill线不是直线而是折线(见下图)。(3)n分子的底物同时和酶作用,反应的级数为n+1,如n-4则为五级反应,这在动力学上是不可能的。但尽管如此,Hill作图法仍不失是一个求取别构酶S0.5和鉴定协同类型及协同作用大小的常用方法。

广范围底物浓度时的Hill图
相关目录
... ...
... ...